新冠疫情疫苗研;疫苗研发进度
新冠疫情研发进度
1. 研发背景
新冠疫情(COVID-19)自2019年底爆发以来,全球各国科学家和企业投入了大量资源进行研发。新冠(SARS-CoV-2)是一种冠状,主要通过呼吸道飞沫传播,具有高度的传染性和致病性。
2. 研发历程
早期研究:2020年初,全球多个研究团队开始对新冠进行基因测序,并快速解析了其结构。
设计:基于对结构的了解,科学家们设计了一系列可能的候选,包括mRNA、腺载体、灭活等。
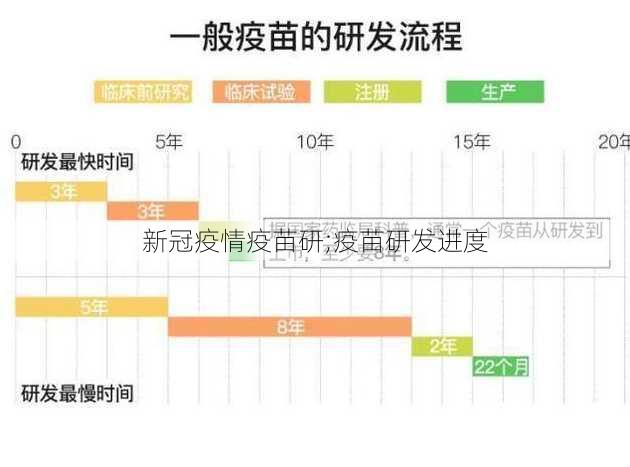
临床试验:研发进入临床试验阶段,包括I期、II期和III期临床试验。
I期临床试验:主要评估的安全性,通常在小规模人群中开展。
II期临床试验:进一步评估的安全性,并初步了解其有效性。
III期临床试验:在更大规模的人群中评估的有效性和安全性。
紧急使用授权:在某些情况下,如疫情严重时,研发方可以申请紧急使用授权,允许在正式批准之前使用。
正式批准:通过III期临床试验,并获得监管机构批准后,可以正式上市。
3. 研发成果
截至目前,全球已有多种新冠获得批准或紧急使用授权,包括以下几种类型:
mRNA:如辉瑞-BioNTech和Moderna,通过编码刺突蛋白的mRNA片段来激活免疫系统。
腺载体:如阿斯利康和强生,利用腺作为载体,将基因片段导入人体细胞。
灭活:如中国国集团和科兴中维,通过灭活来激活免疫系统。
重组蛋白:如Novavax,通过重组刺突蛋白来激活免疫系统。
FAQs
问题1:新冠研发过程中遇到了哪些挑战?
变异:新冠在传播过程中不断发生变异,给研发和有效性评估带来挑战。
临床试验规模:由于疫情紧急,临床试验需要在短时间内完成,对临床试验设计和实施提出较高要求。
安全性:确保在紧急使用过程中的安全性是研发的重要目标。
问题2:新冠的有效性和安全性如何?
有效性:根据临床试验数据,多种新冠在预防COVID-19感染、重症和方面表现出较高的有效性。
安全性:在临床试验中表现出较好的安全性,但仍需继续监测和评估长期安全性。
问题3:新冠是否需要接种加强针?
需要:根据研发方和监管机构建议,部分需要接种加强针以维持免疫效果。
接种时机:加强针的接种时机和次数根据类型和个体免疫状况而定。
注意事项:接种加强针前,请咨询生或专业机构,了解相关注意事项。
相关文章




